Lí thuyết
Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
Kim loại kiềm
Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử
- Kim loại thuộc nhóm IA: liti (Li), natri (Na), kali (K), rubiđi (Rb), xesi (Cs), franxi (Fr).
- Cấu tạo nguyên tử:
- Li: [He]
- Na: [Ne] 3
- K: [Ar] 4
- Rb: [Kr] 5
- Cs: [Xe] 6
- Li: [He]
Tính chất vật lí
- Có màu trắng bạc, có ánh kim, dẫn điện tốt, nhiệt độ nóng chảy và nhiệt độ sôi thấp, khối lượng riêng nhỏ, độ cứng thấp.
Tính chất hóa học
- Tính khử tăng dần từ liti đến xesi.
- Trong hợp chất, kim loại kiềm có số oxi hóa +1:
- Tác dụng với phi kim
- Tác dụng với axit
- Tác dụng với nước
Một số hợp chất quan trọng của kim loại kiềm
Natri hiđroxit
- Là chất rắn, không màu, dễ nóng chảy (t≈332ºC), hút ẩm mạnh, tan nhiều trong nước và tỏa ra một lượng nhiệt lớn.
- Tác dụng được với oxit axit, axit và muối.
Natri hiđrocacbonat
- Là chất rắn màu trắng, ít tan trong nước, dễ bị nhiệt phân hủy tạo ra.
- Có tính lưỡng tính (vừa tác dung với dung dịch axit, bazơ).
Natri cacbonat
- Là chất rắn màu trắng, tan nhiều trong nước.
là muối của axit yếu và có tính chất chung của muối.
là hóa chất quan trọng trong công nghiệp thủy tinh, bột giặt,…
Kali natri
là tinh thể không màu, bền trong không khí, tan nhiều trong nước.
- Nhiệt độ nóng chảy là 333ºC,
bị phân hủy thành
và
.
Kim loại kiềm và hợp chất quan trọng của kim loại kiềm thổ
Kim loại kiềm thổ
Vị trí
- Thuộc nhóm IIA, gồm: beri (Be), magie (Mg), stronti (Sr), bari (Ba) và rađi (Ra).
- Cấu hình electron lớp ngoài cùng là
.
- Be: [He] 2
- Mg: [Ne] 3
- Ca: [Ar] 4
- Sr: [Kr] 5
- Ba: [Xe] 6
- Be: [He] 2
Tính chất vật lý
- Có màu trắng bạc, có thể dát mỏng.
- Nhiệt độ nóng chảy và sôi thấp.
- Khối lượng riêng tương đối nhỏ, tương đối mềm.
Tính chất hóa học
Một số hợp chất quan trọng của canxi
Canxi hiđroxit
(vôi tôi) là chất rắn màu trắng, ít tan trong nước.
↓
là một bazơ mạnh, dùng để sản xuất amoniac (
), clorua vôi (
),…
Canxi cacbonat
- Là chất rắn, màu trắng, không tan trong nước, bị phân hủy ở nhiệt đọ 1000ºC.
tan dần trong nước:
- Dùng đẻ làm vật liệu xây dựng, sản xuất vôi,…
Canxi sunfat
- Là chất rắn màu trắng, tồn tại dưới dạng muối ngậm nước gọi là thạch cao sống.
- Đun nóng ở nhiệt độ 160ºC thạch cao sống sẽ biến thành cao nung:
- Dùng để nặn tượng, đúc khuôn và bó bột khi gãy xương.
Nước cứng
Khái niệm
Tác hại
- Trong đời sống: tắm giặt không sạch, quần áo nhanh hư hỏng.
- Trong sản xuất: tạo cặn, lãng phí nhiên liệu.
Cách làm mềm nước cứng
- Nguyên tắc là giảm nồng độ các ion
và
trong nước cứng.
- Phương pháp kết tủa:
- Đun nóng
- Dùng NaOH
- Dùng
hoặc
- Phương pháp trao đổi ion.
Nhận biết ion 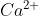 ,
, 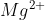 trong dung dịch
trong dung dịch
- Dung dịch muối chứa
tạo ra kết tủa
hoặc
. Sục
dư vào dung dịch nếu kết tủa tan thì chứng tỏ sự có mặt của
,
Nhôm và hợp chát của nhôm
Nhôm
Vị trí
- Ô số 13, nhóm IIIA, chu kì 3 của bảng tuần hoàn.
- Cấu hình electron:
hay [Ne]
.
- Số oxi hóa +3.
Tính chất vật lí
- Là kim loại màu trắng bạc, nóng chảy ở 660ºC, khá mềm, dễ kéo sợi, dễ dát mỏng.
- Là kim loại nhẹ (D=2,7g/
); dẫn điện, nhiệt tốt.
- Trong tự nhiên, nhôm tồn tại dưới dạng hợp chất.
Tính chất hóa học
- Là kim loại có tính khử mạnh, dễ bị oxi hóa thành ion dương:
Tác dụng với phi kim
- Tác dụng với halogen:
- Tác dụng với oxi
Tác dụng với axit
- Al khử dễ dàng ion
trong dung dịch HCl và
loãng thành khí
:
- Nhôm tác dụng mạnh với
loãng;
và
đặc, nóng:
- Nhôm bị thụ động bởi
hoặc
đặc, nguội.
Tác dụng với oxit kim loại
- Al khử được nhiều ion kim loại trong oxit:
Tác dụng với nước
- Al không tác dụng với nước vì trên bề mặt của nhôm được phủ kín 1 lớp
rất mỏng, bền và min, không cho nước và khí thấm qua.
- Nếu phá bỏ lớp oxit, nhôm Al sẽ tác dụng với nước theo phản ứng sau:
Tác dụng với dung dịch kiềm
- Al tác dụng với
O tạo ra
và khí
thoát ra,
tiếp tục tác dụng với dung dịch kiềm NaOH:
=> Al tác dụng trực tiếp với dung dịch kiềm NaOH qua phương trình sau:
Ứng dụng và trạng thái tự nhiên
Ứng dụng
- Dùng để chế tạo máy bay, ô tô, tên lửa, tàu vũ trụ
- Trang trí, xây dựng nhà cửa
- Dẫn điện, nhiệt tốt nên làm dây cáp dẫn điện
Trạng thái tự nhiên
- Nhôm là kim loại hoạt động mạnh, chỉ tồn tại dưới dạng hợp chất
Sản xuất nhôm
- Nguyên liệu: quẵng boxit
thưỡng lẫn
và
- Phương pháp: điện phân nhôm oxit nóng chảy
Một số hợp chất quan trọng của nhôm
Nhôm oxit
Nhôm hiđroxit
- Là chất rắn, màu tráng, kết tủa ở dạng keo.
- Là hiđroxit lưỡng tính, kém bền nhiệt.
- Không tan trong nước, dung dịch
nhưng tan trong môi trường
.
Nhôm sunfat
- Muối nhôm sunfat khan tan trong nước → tạo nhiệt do bị hiđrat hóa
- Phèn chua:
- Dùng trong ngành thuộc da, công nghiệp giấy,…
- Cách nhận biết:
Bài tập
Bài tập 1
Dãy các kim loại nào sau đây là kim loại kiềm?
A. Na, Rb, Cs B. Na, K, Mg C. K, Rb, Ca D. Li, Ra, Cs.
- Đáp án: https://selfomy.com/hoidap/367604/d%C3%A3y-c%C3%A1c-kim-lo%E1%BA%A1i-n%C3%A0o-sau-%C4%91%C3%A2y-l%C3%A0-kim-lo%E1%BA%A1i-ki%E1%BB%81m
Bài tập 2
Hiện tượng nào xảy ra khi cho kali vào dung dịch ?
A. sủi bọt khí không màu và có kết tủa nâu đỏ.
B. sủi bọt khí không màu và có kết tủa trắng xanh.
C. sủi bọt khí không màu và có kết tủa màu đỏ.
D. sủi bọt khí không màu và có kết tủa xanh.
- Đáp án: https://selfomy.com/hoidap/367603/hi%E1%BB%87n-t%C6%B0%E1%BB%A3ng-n%C3%A0o-x%E1%BA%A3y-ra-khi-cho-kali-v%C3%A0o-dung-d%E1%BB%8Bch-fecl_3
Bài tập 3
Dẫn khí vào dung dịch nước vôi trong dư, hiện tượng xảy ra như sau:
A. Thấy xuất hiện kết tủa trắng và kết tủa không tan.
B. Thấy xuất hiện kết tủa trắng và kết tủa tan.
C. Thấy xuất hiện kết tủa trắng xanh và hoá nâu trong không khí.
D. Thấy xuất hiện kết tủa trắng xanh.
- Đáp án: https://selfomy.com/hoidap/367605/d%E1%BA%ABn-kh%C3%AD-co2-v%C3%A0o-dung-d%E1%BB%8Bch-n%C6%B0%E1%BB%9Bc-v%C3%B4i-trong-hi%E1%BB%87n-t%C6%B0%E1%BB%A3ng-x%E1%BA%A3y-nh%C6%B0-sau
Bài tập 4
Cho sơ đồ chuyển đổi hóa học giữa các chất: X → Y → BaCO3 → Z → T. Biết X, Y, Z, T là các hợp chất của Ba và MX < MY < 197 < MZ < MT. Vậy X và T lần lượt là
A. Ba(OH)2 và BaCl2
B. BaO và Ba(HCO3)2
C. BaO và Ba(NO3)2
D. BaO và BaCl2
- Đáp án: https://selfomy.com/hoidap/367613/cho-chuy%E1%BB%83n-%C4%91%E1%BB%95i-h%C3%B3a-h%E1%BB%8Dc-gi%E1%BB%AFa-c%C3%A1c-ch%E1%BA%A5t-baco3%C2%A0%E2%86%92-bi%E1%BA%BFt-c%C3%A1c-h%E1%BB%A3p-ch%E1%BA%A5t
Bài tập 5
Nung 100g hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khi khối lượng của hỗn hợp không đổi, được 69 g chất rắn. Xác định thành phần % khối lượng của mỗi chất trong hỗn hợp ban đầu.
- Đáp án: https://selfomy.com/hoidap/367614/nung-100g-h%E1%BB%A3p-g%E1%BB%93m-na2co3-nahco3-cho-%C4%91%E1%BA%BFn-kh%E1%BB%91i-l%C6%B0%E1%BB%A3ng-kh%C3%B4ng-%C4%91%C6%B0%E1%BB%A3c
Bài tập 6
Trong một cốc nước có chứa 0,01 mol Na+ , 0,02 mol Ca2+, 0,01 mol Mg2+, 0,05 mol HCO3–, 0,02 mol Cl–. Nước trong cốc thuộc loại nào ?
A. Nước cứng có tính cứng tạm thời.
B. Nước cứng có tính cứng vĩnh cửu.
C. Nước cứng có tính cứng toàn phần.
- Đáp án: https://selfomy.com/hoidap/367616/trong-m%E1%BB%99t-c%E1%BB%91c-n%C6%B0%E1%BB%9Bc-ch%E1%BB%A9a-mol-na-02-mol-ca2-01-mol-mg2-mol-hco3-mol
Bài tập 7
Điện phân Al2O3 nóng chảy với dòng điện cường độ 9,65 A trong thời gian 3000 giây, thu được 2,16 g Al. Hiệu suất của phản ứng là bao nhiêu?
- Đáp án: https://selfomy.com/hoidap/367617/%C4%91i%E1%BB%87n-ph%C3%A2n-al2o3-ch%E1%BA%A3y-d%C3%B2ng-%C4%91i%E1%BB%87n-c%C6%B0%E1%BB%9Dng-trong-th%E1%BB%9Di-gian-gi%C3%A2y-%C4%91%C6%B0%E1%BB%A3c
Bài tập 8
Thực hiện phản ứng nhiệt nhôm (trong điều kiện không có oxi) hỗn hợp gồm Fe3O4 và Al, thu được 96,81 gam hỗn hợp bột X. Trộn đều và chia X thành hai phần, phần hai có khối lượng gấp 4 lần khối lượng phần một. Phần một tác dụng vừa đủ với 100 ml dung dịch NaOH 1,5M. Phần hai khi tác dụng với dung dịch HNO3 đặc nóng dư, thu được V lít khí NO2 (sản phẩm khử duy nhất ở đktc). Giá trị của V là
A. 72,576 lít
B. 57,792 lít
C. 46,2336 lít
D. 75,576 lít
- Đáp án: https://selfomy.com/hoidap/367619/th%E1%BB%B1c-hi%E1%BB%87n-ph%E1%BA%A3n-%E1%BB%A9ng-nhi%E1%BB%87t-nh%C3%B4m-trong-%C4%91i%E1%BB%81u-ki%E1%BB%87n-kh%C3%B4ng-fe3o4-%C4%91%C6%B0%E1%BB%A3c
Bài tập 9
Hỗn hợp X gồm a mol Al và 0,05 mol Al2O3. Cho hỗn hợp X tác dụng với NaOH đủ, thu được dung dịch Y. Thêm dung dịch chứa 3a mol HCl vào dung dịch Y, thu được kết tủa Z. Nung kết tủa Z đến khối lượng không đổi, thu được 10,2 gam chất rắn (biết các phản ứng xảy ra hoàn toàn). Giá trị của a là
- Đáp án: https://selfomy.com/hoidap/367668/h%E1%BB%97n-h%E1%BB%A3p-g%E1%BB%93m-mol-al-v%C3%A0-05-mol-al2o3-cho-h%E1%BB%97n-h%E1%BB%A3p-t%C3%A1c-d%E1%BB%A5ng-v%E1%BB%9Bi-naoh-%C4%91%E1%BB%A7








No Comments
Leave a comment Cancel