Tính chất vật lí:
Kiến thức phổ thông
– Ở điều kiện thường, clo ở thể khí, màu vàng lục nhạt, có mùi hắc khó ngửi. và là chất độc cực mạnh, phá hoại nghiêm trọng niêm mạc của đường hô hấp. Vì thế, clo đã là một trong các loại khí được sử dụng trong Chiến tranh thế giới thứ hai như một vũ khí hóa học.
– Clo nặng gấp 2,5 lần không khí, tan trong nước, tan nhiều hơn các dung môi hữu cơ như benzene, etanol, hexan, …
– Ở 20 độ C, 1 thể tích nước hoà tan được 2,5 thể tích clo. Dung dịch khí clo trong nước còn gọi là nước clo có màu vàng nhạt.
Mở rộng:
– Clo là khí độc cực mạnh, có khả năng phá hoại nghiêm trọng niêm mạc của đường hô hấp.
-Vì vậy nó từng được sử dụng làm vũ khí hóa học trong Chiến tranh Thế giới lần thứ hai


Tính chất hoá học
– Nguyên tử clo có độ âm điện lớn (3,16), chỉ đứng sau flo và oxi.
– Vì vậy, trong hợp chất với các nguyên tố này, clo có số oxi hoá dương (+1, +3, +5, +7) còn trong các hợp chất khác clo có số oxi hoá là (-1).


– Từ đó, ta có thể hiểu rằng:
+ Khi tham gia phản ứng, các nguyên tử clo dễ dàng nhận them 1e để trở thành ion.
+ Vì vậy, tính chất hoá học cơ bản của clo là tính oxi hoá mạnh.
– Tính chất này được thể hiện qua các phản ứng sau:
Tác dụng với kim loại
– Khí clo oxi hoá được hầu hết các kim loại ở nhiệt độ thường hoặc không cao lắm, tạo ra các muối clorua với tốc độ nhanh, toả nhiều nhiệt.
– Ví dụ:
+ Natri nóng chảy trong khí clo với ngọn lửa sáng chói, tạo ra natri clorua:
+ Dây đồng cháy trong khí clo tạo thành khói màu vàng nâu:
+ Dây sắt phản ứng mãnh liệt với khí clo, tạo thành khói màu nâu:
Tác dụng với hidro
– Ở nhiệt độ thường và trong bóng tối, khí clo hầu như không phản ứng với khí hidro.
– Khi chiếu ánh sáng hỗn hợp hoặc hơ nóng, phản ứng xảy ra nhanh.
– Với tỉ lệ 1:1, phản ứng gây nổ mạnh.
– PTHH:
Tác dụng với nước
– Khi tan trong nước, 1 phần khí clo tác dụng với nước tạo ra hỗn hợp axit clohidric và axit hipoclorơ.
– PTHH:
– Trong phản ứng trên, clo đóng vai trò vừa là chất khử, vừa là chất oxi hoá.
– Phản ứng trên là phản ứng thuận nghịch do HClO là chất oxi hoá rất mạnh, có thể oxi hoá HCl thành khí clo và nước. Và vì thế, HClO có tính tẩy màu rất tốt.
Trạng thái tự nhiên
– Trong tự nhiên, clo có 2 đồng vị là Cl (75,77%) và
Cl (24,23%), nguyên tử khối trung bình là 35,5.
– Do hoạt động hoá học mạnh nên trong tự nhiên, clo chỉ tồn tại ở dạng hợp chất, phần lớn là muối NaCl có trong muối biển (1 lít nước biển có chứa khoảng 30g NaCl) và muối mỏ.
– Hợp chất khác của clo cũng phổ biến trong tự nhiên như quặng cacnalit , quặng xivinvit
,…
– Axit clohidric HCl cũng có trong dịch vị dạ dày của động vật và con người với nồng độ khoảng từ 0,0001 đến 0,001 mol/l (có độ pH tương ứng là 4 và 3) .
Ứng dụng
– Dùng để diệt trùng nước sinh hoạt
– Tẩy trắng vải sợi, giấy,…
– Sản xuất các hoá chất hữu cơ vô cùng quan trọng như thuốc trừ sâu, dung môi , nhựa PVC, cao su tổng hợp, sợi tổng hợp
– Ngoài ra còn có các loại chất dẻo như nhựa PVC poli-vinylclorua, cao su tổng hợp, sợi tổng hợp


Điều chế
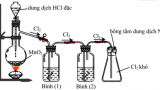
Trong phòng thí nghiệm
– Khí clo được điều chế bằng cách cho axit clohidric tác dụng với các chất oxi hoá mạnh như mangan oxit, kali pemaganat,…
– PTHH:
– PTHH:
Trong công nghiệp
– Trong công nghiệp, người ta điều chế clo bằng cách điện phân dung dịch bão hoà muối ăn
– Thùng điện phân có màng ngăn cách 2 điện cực để khí clo không tiếp xúc với NaOH.
– PTHH:




No Comments
Leave a comment Cancel