

Vị trí của kim loại trong bảng tuần hoàn
Các nguyên tố hóa học được phân thành kim loại và phi kim.
Hơn 80% các nguyên tố hóa học là kim loại và chúng có mặt ở:
- Nhóm IA và IIA ( trừ H, He ): là những nguyên tố s
- Nhóm IIIA (trừ Bo), Sn, Pb (nhóm IVA), Bi (nhóm VA) và Po (nhóm VIA): là những nguyên tố p
- Thuộc các nhóm B (từ IB đến VIIIB): là những nguyên tố D
- Họ Lantan và họ Actini (được xếp riêng thành hai hàng ở cuối bảng ): là những nguyên tố f
=> Kim loại tập trung ở phía dưới và bên trái của bảng tuần hoàn.
Cấu tạo của kim loại
Cấu tạo nguyên tử
Nguyên tử của hầu hết các nguyên tố kim loại đều có ít electron ở lớp ngoài cùng (1, 2 hoặc 3e)
Ví dụ: Na: [Ne]3s1
Mg: [Ne]3s2
Al: [Ne]3s23p1
Bán kính nguyên tử lớn và điện tích hạt nhân nhỏ so với các phi kim trong cùng chu kì
Năng lượng ion hóa thấp và độ âm điện nhỏ so với các phi kim cùng chu kỳ
Cấu tạo tinh thể
Ở nhiệt độ thường, hầu hết kim loại ở thể rắn và có cấu tạo tinh thể (trừ thủy ngân ở thể lỏng)
Phần lớn có cấu tạo đặc khít.
3 kiểu mạng tinh thể của hầu hết kim loại: mạng lục phương (74%), lập phương tâm diện (74%), lập phương tâm khối (68%)
Cấu trúc tinh thể kim loại phụ thuộc vào số electron s và p độc thân trung bình trên một nguyên tử kim loại ở trạng thái kích thích: a
- a < 1,5: lập phương tâm khối
- 1,7 < a < 2,1: lục phương
- 2,5 < a < 3,2: lập phương tâm diện
- a ~ 4: mạng tinh thể kim cương
Ví dụ:
Na: 1s²2s²2p3s¹ -> a = 1 => mạng tinh thể lập phương tâm khối
Mg: 1s²2s²2p3s² -> a = 2 => mạng tinh thể lục phương
Al: 1s²2s²2p3s²3p¹ -> a = 3 => mạng tinh thể lập phương tâm diện


- Nút mạng là các cation hoặc nguyên tử kim loại dao động xung quanh vị trí nhất định.
- Giữa các nút mạng là rất nhiều các e có thể chuyển động tương đối tự do
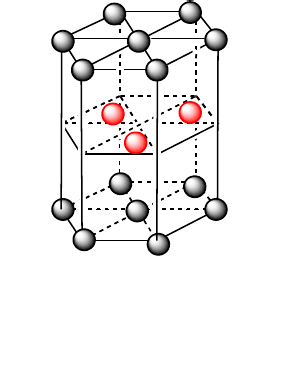
Mạng tinh thể lục phương


- Dạng hình học giống như hình lăng trụ có đáy là hình lục giác
- Không gian trong tinh thể trống 26%, thể tích của các nguyên tử và ion kim loại chiếm 74%
- Thường được gọi là cấu trúc tinh thể magie
- Lục phương: Be, Mg, Zn,…


Mạng tinh thể lập phương tâm diện
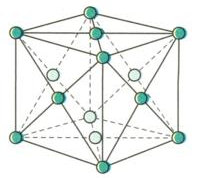

- Đỉnh và tâm các mặt của khối hộp lập phương là các nguyên tử hoặc ion dương kim loại
- Trong số các kim loại có cấu trúc tinh thể này, người ta thường đề cập đến Cu. Vì vậy đây còn gọi là cấu trúc tinh thể đồng
- Không gian trong tinh thể trống 26%, thể tích của các nguyên tử và ion kim loại chiếm 74%
- Lập phương tâm diện: Pb, Cu, Ag, Al,…
Mạng tinh thể lập phương tâm khối
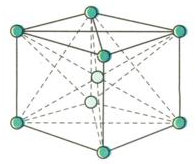

- Đỉnh và tâm của hình lập phương là nguyên tử hay ion dương kim loại
- Trong số các kim loại có cấu trúc tinh thể này, người ta thường đề cập đến Wolfram (W). Vì vậy đây còn gọi là cấu trúc tinh thể Wolfram
- Không gian trong tinh thể trống 32%, thể tích của các nguyên tử và ion kim loại chiếm 68%
- Lập phương tâm khối: các kim loại kiềm, Cr, Fe, Mo…
Liên kết kim loại
Liên kết kim loại là liên kết bên trong của các kim loại
Liên kết kim loại được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do có sự tham gia của các electron tự do.
Liên kết kim loại đặc trưng cho nhiều tính chất vật lý của kim loại, chẳng hạn như tính dễ dát mỏng, kéo dài, tính dẫn điện và dẫn nhiệt cũng như ánh kim






No Comments
Leave a comment Cancel