Hợp chất của Fe(II)
Tính chất hóa học đặc trưng của Fe(II) là tính khử.
| Tính chất vật lí | Tính chất hóa học | Điều chế | |
|
Sắt (II) oxit |
Là chất rắn màu đen, không có trong tự nhiên. |
FeO tác dụng với HCl được muối sắt(II): |
FeO có thể điều chế bằng cách dùng H2 hay CO khử Fe2O3 ở 500°C: |
|
Sắt(II) hiđroxit |
Fe(OH)2 nguyên chất là chất rắn, màu trắng hơi xanh, không tan trong nước. |
Trong không khí dễ bị oxi hóa thành Fe(OH)3 màu nâu đỏ. |
Cho Fe(OH)2 vào dung dịch kiềm thu được kết tủa màu trắng hơi xanh, sau đó chuyển sang màu đỏ: |
|
Muối sắt(II) |
Đa số tan trong nước, khi kết tinh thường ở dạng ngậm nước. VD: \( FeSO_4.7H_2O; FeCl_2.4H_2O \) |
Dễ bị oxi hóa thành muối sắt(III) bởi các chất oxi hóa. VD: \( 2FeCl_2+Cl_2\rightarrow 2FeCl_3 \) |
Điều chế bằng cách cho Fe tác dụng với HCl hoặc H2SO4 loãng. Chú ý: muối sắt(II) để trong không khí sẽ chuyển dàn thành muối sắt(III). |
Hợp chất của Fe(III)
Tính chất hóa học đặc trưng của Fe(III) là tính oxi hóa.
|
Tính chất vật lí |
Tính chất hóa học |
Điều chế, ứng dụng |
|
|
Sắt(III) oxit |
Là chất rắn màu đỏ nâu, không tan trong nước. |
Là oxit bazơ, dễ tan trong các dung dịch axit mạnh: |
Bằng phản ứng phân hủy Fe(OH)3 ở nhiệt độ cao: Có trong tự nhiên dưới dạng quặng hematit dùng để luyện gang. |
|
Sắt(III) hiđroxit |
Là chất rắn, màu nâu đỏ, không tan trong nước. |
Dễ tan trong dung dịch axit tạo thành muối sắt (II): |
Điều chế bằng cách cho dung dịch kiềm tác dụng với muối sắt(III): |
|
Muối sắt(III) |
Đa số tan trong nước, khi kết tinh thường ở dạng ngậm nước. VD: \( FeCl_3.6H_2O; Fe_2(SO_4)_3.9H_2O \) |
Có tính oxi hóa, dễ bị khử thành muối sắt(II). | Được dùng làm chất xúc tác trong tổng hợp hữu cơ. |
Bài tập
Bài tập 1: Viết phương trình hóa học của các phản ứng trong quá trình chuyển đổi sau:
Đáp án: https://selfomy.com/hoidap/367670/chu%E1%BB%97i-ph%E1%BA%A3n-%E1%BB%A9ng-li%C3%AAn-quan-%C4%91%E1%BA%BFn-s%E1%BA%AFt-fe
Bài tập 2: Vị trí của Fe trong bảng tuần hoàn
A. Ô 26, chu kì 4, nhóm VIB, Fe là nguyên tố phi kim
B. Ô 26, chu kì 4, nhóm VIIB, Fe là nguyên tố kim loại chu kì nhóm B
C. Ô 26, chu kì 4, nhóm VIIIB, Fe là nguyên tố kim loại chu kì nhóm B
D. Ô 26, chu kì 4, nhóm VB, Fe là kim loại chu kì nhóm B
Đáp án: https://selfomy.com/hoidap/367669/v%E1%BB%8B-tr%C3%AD-c%E1%BB%A7a-fe-trong-b%E1%BA%A3ng-tu%E1%BA%A7n-ho%C3%A0n
Bài tập 3: Tính chất vật lý đặc trưng của Fe so với các kim loại khác là
A. Tính dẻo cao.
B. Màu trắng xám.
C. Dẫn điện, dẫn nhiệt tốt
D. Nhiễm từ.
Đáp án: https://selfomy.com/hoidap/367671/t%C3%ADnh-ch%E1%BA%A5t-v%E1%BA%ADt-l%C3%BD-%C4%91%E1%BA%B7c-tr%C6%B0ng-c%E1%BB%A7a-fe-so-v%E1%BB%9Bi-c%C3%A1c-kim-lo%E1%BA%A1i-kh%C3%A1c-l%C3%A0-g%C3%AC
Bài tập 4: Ngâm một đinh sắt nặng 4 gam trong dung dịch CuSO4, sau một thời gian lấy đinh sắt ra, sấy khô, cân nặng 4,2857 gam. Khối lượng Fe tham gia phản ứng là
Đáp án:
Bài tập 5
Một lượng Fe phản ứng hoàn toàn với H2O ở 600∘C thu được 2.25 lít H2. Cùng khối lượng Fe như trên phản ứng hoàn toàn với H2O ở 550∘C thu được số lít khí H2 là (các thể tích khí đo ở cùng điều kiện)
A. 2,987 lít.
B. 1,68 lít.
C. 3,36 lít.
D. 2,24 lít.
Đáp án:

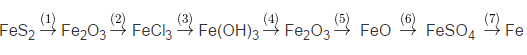







No Comments
Leave a comment Cancel