Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử
Tính chất vật lí
- Sắt là kim loại màu trắng hơi xám
- Khối lượng riêng lớn (D=7,9g/cm3), là kim loại nặng
- Nóng chảy ở 1540°C
- Sắt có tính dẫn điện, dẫn nhiệt tốt.
- Khác với kim loại khác, sắt có tính nhiễm từ.
Tính chất hóa học
- Sắt là kim loại có tính khử trung bình. Khi tác dụng với chất oxi hóa yếu, sắt từ bị oxi hóa đến số oxi hóa +2.
\( Fe \rightarrow Fe^{2+} + 2e \) - Với chất oxi hóa mạnh, sắt bị oxi hóa đến số oxi hóa +3, điển hình là clo:
\( 2Fe + 3Cl_{2} \overset{t^{o}}{\rightarrow} 2FeCl_{3} \)
Tác dụng với phi kim
- Ở nhiệt độ cao, sắt khử nguyên tử phi kim thành ion âm và bị oxi hóa đến số oxi hóa +2 hoặc +3.
Tác dụng với lưu huỳnh
Khi đun nóng, Fe khử S xuống số oxi hóa -2, còn sắt bị oxi hóa đến số oxi hóa +2.
\( Fe + S \overset{t^{0}C}{\rightarrow} FeS \)


Tác dụng với oxi
Khi đun nóng, Fe khử oxi đến số oxi hóa -2.
\( 3Fe + 2O_{2 }\xrightarrow{t\circ} Fe_{3}O_{4} \)
Tác dụng với clo
Fe khử Cl2 đến số oxi hóa -1, còn Fe bị oxi hóa đến số oxi hóa cao nhất, +3.
\( 2Fe + 3Cl_{2 }\xrightarrow{t\circ} 2FeCl_{3} \)
Tác dụng với axit
Với dung dịch HCl, H2SO4 loãng
Fe khử ion H+ của các dung dịch HCl, H2SO4 loãng thành H2, Fe bị oxi hóa đến số oxi hóa +2
\( Fe + H_{2}SO_{4}\rightarrow FeSO_{4} +H_{2} \)
Với dung dịch HNO3 và H2SO4 đặc, nóng
- Fe khử N+5 hoặc S+6 trong dung dịch HNO3 hoặc H2SO4 đặc, nóng xuống số oxi hóa thấp hơn, còn Fe bị oxi hóa đến số oxi hóa cao nhất, +3.
\( Fe +4HNO_3 \rightarrow Fe(NO_3)_3+NO+2H_2O \) - Fe bị thụ động bởi các axit HNO3 đặc, nguội hoặc H2SO4 đặc, nguội.
Tác dụng với dung dịch muối
- Fe có thể khử được ion của các kim loại đứng sau nó trong dãy điện hóa của kim loại. Trong các phản ứng này, Fe thường bị oxi hóa đến số oxi hóa +2.
- Fe cũng có thể bị oxi hoá số oxi hoá +3.
- Các phản ứng xảy ra được phải tuân theo quy tắc con cá vàng (phải vẽ được đường \( \alpha \) của phản ứng).
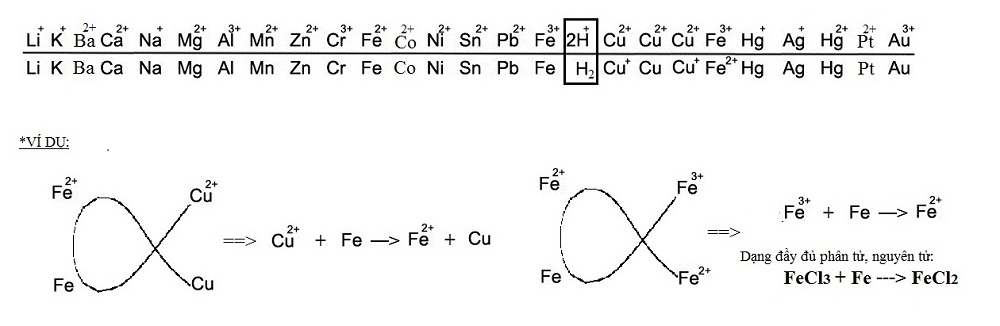
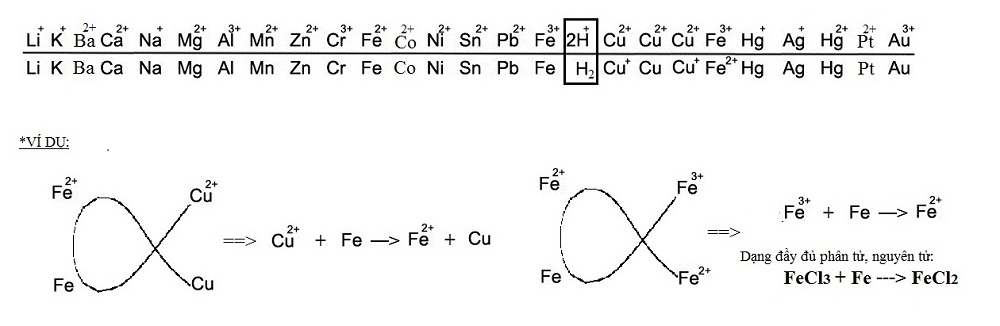
- Ví dụ:
- \( Fe+CuSO_4\rightarrow Cu+FeSO_4 \)
- \( Fe+2AgNO_3\rightarrow 2Ag+Fe(NO_3)_2 \)
Tác dụng với nước
- Ở nhiệt độ thường, sắt không khử được nước, nhưng ở nhiệt độ cao sắt khử nước tạo ra H2 và Fe3O4 hoặc FeO:
- \( 3Fe+4H_2O \xrightarrow{t\circ <{570\circ}C}Fe_3O_4+3H_2 \)
- \( Fe+H_2O\xrightarrow{t\circ >{570\circ}C} FeO+H_2 \)


Trạng thái tự nhiên













People reacted to this story.
Show comments Hide comments1