Điều chế kim loại
Nguyên tắc
Khử ion kim loại thành nguyên tử kim loại
Các phương pháp
Phương pháp thủy luyện
- Chủ yếu dùng để điều chế kim loại có tính khử yếu hơn Al
- Là phương pháp dùng kim loại có tính khử mạnh khử ion kim loại yếu hơn trong dung dịch muối
Phương pháp nhiệt luyện
- Dùng chất khử như CO, H2, Al,.. để khử ion kim loại trong oxit ở nhiệt độ cao
- Phạm vi sử dụng: thường dùng trong công nghiệp với kim loại sau Al
Phương pháp điện phân
Sự điện phân là quá trình oxi hóa – khử xảy ra ở bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li
Điện phân nóng chảy
- Dùng dòng điện một chiều để khử ion kim loại trong muối (oxit, hidroxit) ở trạng thái nóng chảy hoặc trạng thái dung dịch
- Phạm vi sử dụng: có thể dùng để điều chế tất cả các kim loại nhưng thường dùng với kim loại mạnh: K, Na, Mg, Ca, Ba và Al
Điện phân dung dịch
- Dùng dòng điện một chiều khử ion kim loại yếu trong dung dịch muối của nó.
- Phạm vi sử dụng: Dùng điều chế các kim loại yếu
Sự ăn mòn kim loại
Khái niệm
Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh
Phân loại
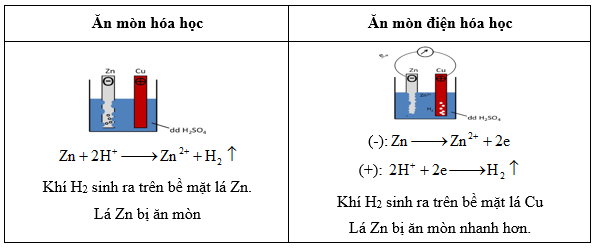
| Ăn mòn điện hóa | Ăn mòn hóa học | |
| Định nghĩa | Là sự phá hủy kim loại do kim loại tiếp xúc với dung dịch chất điện li tạo nên dòng điện | Là sự phá hủy kim loại do kim loại phản ứng hóa học với chất khí hoặc hơi nước ở nhiệt độ cao |
| Đặc điểm | Phát sinh dòng điện | Không phát sinh dòng điện và nhiệt độ càng cao thì tốc độ ăn mòn càng nhanh |
| Bản chất | Là quá trình oxi hóa khử xảy ra trên bề mặt các điện cực |
Là quá trình oxi hóa khử (trong đó các e của kim loại chuyển trực tiếp sang môi trường tác dụng) |
| Điều kiện ăn mòn điện hóa |
Các điện cực phải khác chất nhau. Trong đó kim loại có tính khử mạnh sẽ là cực âm Các điện cực tiếp xúc với nhau ( trực tiếp hoặc gián tiếp qua dây dẫn ) Các điện cực cùng tiếp xúc với một dung dịch điện ly |
|
| Cơ chế ăn mòn điện hóa |
Nếu dung dịch điện li là axit thì tại cực dương: Nước có hòa tan oxi, hoặc dung dịch chất điện ly trung tính, hoặc dung dịch bazo có thể ăn mòn điện hóa với nhiều kim loại thì ở cực dương có sự khử oxi: |
|
Chống ăn mòn kim loại
Cách li kim loại với môi trường: phủ lên bề mặt kim loại một lớp sơn, dầu mỡ, chất dẻo hoặc tráng, mạ bằng một kim loại khác
Phương pháp điện hóa: dùng một kim loại có tính khử mạnh hơn làm vật đóng vai trò cực âm và bị ăn mòn để bảo vệ vật liệu kim loại.

No Comments
Leave a comment Cancel