Axit – Bazo
-
Định nghĩa
| Axit | Bazo | |
| Theo Areniut | Chất khi tan trong nước phân li ra cation H+ | Chất khi tan trong nước phân li ra anion OH– |
| Theo Bronstet | Chất nhường proton | Chất nhận proton |
| Dung dịch | Tính chất chung là tính chất của anion H+ |
Tính chất chung là tính chất của cation OH– |
| Phân loại |
Vd: HNO3, HCl,…
Vd: H2S, H2SO4, H3PO4,… (Có nhiều H+ trong phân tử) H3PO4 H2PO4 – + H+ H2PO4 – HPO42- + H+ HPO42- PO43- + H+ |
Vd: NaOH, KOH,..
Vd: Ca(OH)2, Mg(OH)2,… (Có nhiều nhóm OH– trong phân tử) |
|
||
Hidroxit lưỡng tính
Hidroxit lưỡng tính là hidroxit khi tan trong nước vừa có thể phân li ra axit vừa có thể phân li ra ion.
- Gồm: Zn(OH)2; Sn(OH)2; Be(OH)2; Pb(OH)2; Al(OH)3; Cr(OH)3.
Vd: Zn(OH)2
Phân li theo kiểu bazo: Zn(OH)2
Zn2+ + 2OH–
Phân li theo kiểu axit: Zn(OH)2
ZnO22– + 2H+
Muối
-
Định nghĩa
Muối là hợp chất khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit.
Vd: Na2SO4, CH3COONa, NH4Cl,…
-
Phân loại
| Muối trung hòa | Muối axit |
|
Muối mà anion gốc axit không còn hiđro có khả năng phân li ra H+ Vd: Na2SO4 2Na+ + SO4– |
Muối mà anion gốc axit vẫn còn hiđro có khả năng phân li ra H+. Vd: NaHSO4 Na+ + HSO4– HSO4– H+ + SO42- |
**Lưu ý: NaHPO3, NaH2PO2 là muối trung hòa (vì HPO32- ; H2PO2– không phân li ra ion H+.




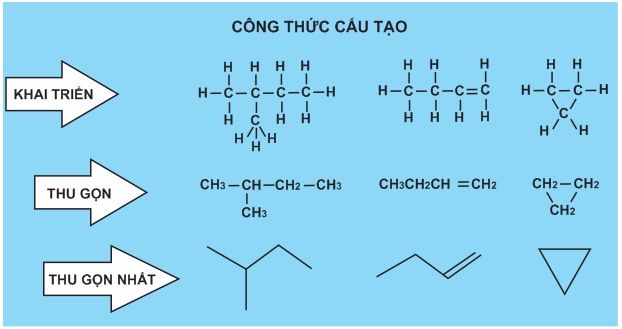






No Comments
Leave a comment Cancel