Nước là chất điện li rất yếu
Sự điện li của nước
– Nước dẫn điện cực kì yếu.
– Cứ 555 triệu phân tử H2O thì chỉ có 1 phân tử phân li ra ion


*Cấu tạo phân tử H2O*
Tích số ion của nước
Tích số ion của nước là:
Ý nghĩa tích số ion của nước
-
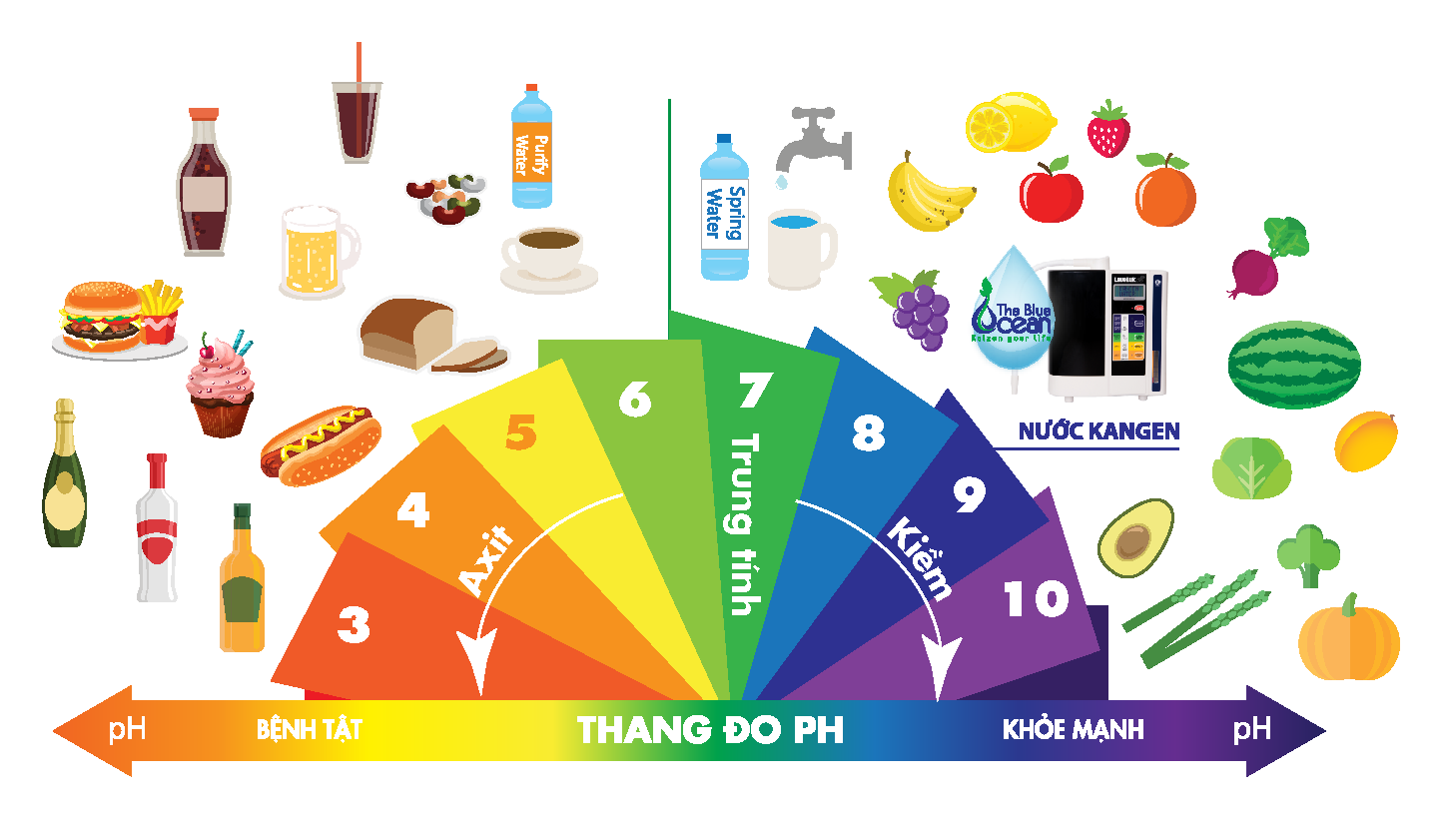
Môi trường axit
Môi trường axit là môi trường trong đó:
-
Môi trường kiềm
Môi trường kiềm là môi trường trong đó:
-
Môi trường trung tính
Môi trường trung tính là môi trường trong đó:
Khái niệm về pH. Chất chỉ thị Axit – Bazo
Độ pH
-
Khái niệm
pH = -Log[H+] là thông số để đánh giá độ axit – bazo của dung dịch.
| Môi trường axit | Môi trường kiềm | Môi trường trung tính |
| pH < 7 | pH > 7 | pH = 7 |
Thang pH có giá trị từ 1 đến 14:


-
Ý nghĩa
– Nồng độ pH trong đất ảnh hưởng trực tiếp đến sự sinh trưởng của thực vật.
– Nồng độ pH trong nước ảnh hưởng đến tốc độ ăn mòn của kim loại.
1 vài giá trị pH của một số dịch lỏng thông thường:
| Mẫu | pH |
| Dịch dạ dày | 1.0 – 2.0 |
| Nước chanh | ∼ 2.4 |
| Giấm | 3.0 |
| Nước nho | ∼ 3.2 |
| Nước cam | ∼ 3.5 |
| Nước tiểu | 4.8 – 7.5 |
| Nước để ngoài không khí | 5.5 |
| Nước bọt | 6.4 – 6.9 |
| Sữa | 6.5 |
| Máu | 7.3 – 7.45 |
| Nước mắt | 7.4 |
-
Công thức
pH = – log[H+]
pH = 14 – pOH = 14 – (-log[OH-])
Chất chỉ thị axit – bazo
– Là chất biến đổi màu phụ thuộc vào giá trị pH của dung dịch.
| Quỳ |
Đỏ pH < 7 |
Tím pH = 7 |
Xanh pH > 7 |
| Phenolphtalein |
Không màu pH < 8.3
|
Màu hồng
|
|








No Comments
Leave a comment Cancel