Amoniac
Cấu tạo phân tử


*Nito liên kết với 3 nguyên tử Hidro bằng 3 liên kết cộng hóa trị có cực (electron lệch về phía nito)*
Tính chất vật lý
– Là chất khí không màu, có mùi khai và xốc, tan nhiều trong nước tạo dd amoniac.
Tính chất hóa học
-
Tính bazo yếu
-
Tác dụng với nước
– Tan trong nước, phân li ra ion OH- làm cho dd có tính bazo và dẫn điện.
-
Tác dụng với dung dịch muối
– Tác dụng với dd muối của nhiều kim loại tạo kết tủa hidroxit của kim loại đó.
-
Tác dụng với axit
-
Tính khử
-
Tác dụng với oxi
– Amoniac cháy trong oxi tạo ngọn lửa màu vàng
-
Tác dụng với Clo
(NH3 kết hợp ngay với HCl tạo “Khói trắng NH4Cl)
-
Phản ứng tạo phức
– Dung dịch NH3 hòa tan được hidroxit và muối ít tan của 1 số kim loại (Ag+, Cu2+, Zn2+,…) tạo phức.
Ứng dụng
– Sản xuất axit nitric, phân đạm, phân ure amoni nitrat, amoni sunfat,…
– Điều chế hidrazin (N2H4) nhiên liệu của tên lửa.
– Amoniac lỏng làm chất làm lạnh trong thiết bị lạnh.
Điều chế
-
Trong phòng thí nghiệm
-
Trong công nghiệp
Muối amoni
Tính chất vật lý
– Là chất tinh thể ion, tan nhiều trong nước, khi tan điện li hoàn toàn thành các ion, Ion NH4+ ko có màu.
Tính chất hóa học
-
Tác dụng với dung dịch kiềm
(Phản ứng nhận biết muối amoni)
-
Phản ứng nhiệt phân








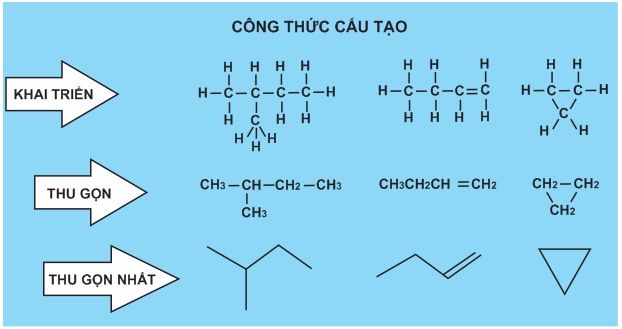


No Comments
Leave a comment Cancel